Radioaktivität ist ein natürlicher Prozess, bei dem instabile Atomkerne Energie in Form von Strahlung freisetzen. Dabei wandelt sich das Atom in eine stabilere Form um – häufig verändert es sich sogar in ein anderes Element. Radioaktivität umgibt uns überall, und der Großteil davon ist völlig natürlich.
Alltägliche Beispiele für natürliche Radioaktivität:
- In der Erde: Gesteine und Böden enthalten von Natur aus radioaktive Elemente, die seit der Entstehung der Erde existieren und auch heute noch langsam zerfallen.
- In der Luft: Das Gas Radon kann in Kellern oder in Gebieten mit viel Gestein vorkommen. Während eine übermäßige Belastung vermieden werden sollte, sind geringe Mengen normal und unbedenklich.
- In unseren Lebensmitteln: Viele Lebensmittel enthalten geringe Mengen des natürlich vorkommenden Kalium-40. Bananen, Nüsse und Kartoffeln sind zum Beispiel leicht radioaktiv – aber vollkommen unbedenklich zum Verzehr.
- In unserem Körper: Unser Körper enthält auf natürliche Weise radioaktive Isotope wie Kohlenstoff-14 und Kalium-40, da wir sie über Nahrung, Wasser und Luft aufnehmen.
- Aus dem Weltraum: Wir sind ständig kosmischer Strahlung von Sonne und Weltraum ausgesetzt. In größeren Höhen, etwa bei Flugreisen, ist diese Belastung leicht erhöht.
Natürliche Radioaktivität ist ein normaler Bestandteil des Lebens auf der Erde. Sie ist nicht grundsätzlich gefährlich – im Gegenteil, das Leben hat sich in ihrer Gegenwart entwickelt. Entscheidend ist, sie verantwortungsvoll zu verstehen und zu handhaben, insbesondere beim Umgang mit radioaktiven Materialien in Wissenschaft und Medizin.
Die einzigartigen Vorteile der Radioaktivität in Wissenschaft und medizinischer Forschung
Radioaktive Methoden bieten deutliche Vorteile gegenüber nicht-radioaktiven Verfahren in den Lebenswissenschaften und der medizinischen Forschung. Aufgrund ihrer hohen Rückverfolgbarkeit und Quantifizierbarkeit sind radiomarkierte Verbindungen heute ein unverzichtbares Werkzeug in Disziplinen wie Pharmakokinetik, Molekularbiologie, Wirkstoffentwicklung und diagnostischer Bildgebung.
- Unvergleichliche Sensitivität
Radiometrische Nachweismethoden erlauben die Quantifizierung von Substanzen in extrem niedrigen (Tracer-)Konzentrationen, oft im Pikomolar- oder Femtomolarbereich. Diese Sensitivität übertrifft die von spektroskopischen, fluoreszenten oder massenspektrometrischen Techniken – insbesondere in komplexen biologischen Matrizes, in denen Hintergrundrauschen nicht-radioaktive Methoden stören kann.
- Quantitative Genauigkeit
Im Gegensatz zu Fluoreszenz- oder kolorimetrischen Assays unterliegt Radioaktivität weder Photobleaching noch matrixabhängigen Signalverschiebungen. Die Signalintensität korreliert direkt mit der Anzahl der Zerfälle pro Minute (dpm) und ermöglicht eine absolute Quantifizierung ohne Standardkurven oder interne Kalibrierung.
- Molekulare Stabilität
Radiomarkierte Verbindungen – insbesondere mit Isotopen wie C-14 oder H-3 – behalten ihre ursprüngliche chemische Struktur bei, wodurch das biologische Verhalten unverändert bleibt. Im Gegensatz dazu können fluoreszierende Tags oder sperrige Marker die Aktivität, Bindungsaffinität oder Transportcharakteristika eines Moleküls beeinflussen.
- Ideal für Langzeit- und In-vivo-Studien
Langlebige Isotope (z. B. C-14) ermöglichen Langzeitstudien zu Stoffwechsel, Absorption oder Abbau, mit stabilen Signalen über Wochen oder Monate. In-vivo-Bildgebungstechniken mit kurzlebigen Isotopen (z. B. F-18 in PET-Scans) liefern Echtzeit-Visualisierungen biologischer Prozesse im gesamten Körper bei minimaler Belastung für die Patienten.
- Regulatorische Akzeptanz
Radiomarkierung, insbesondere mit C-14, gilt als Goldstandard in ADME-Studien (Absorption, Distribution, Metabolismus, Exkretion), die für die Zulassung von Arzneimitteln erforderlich sind. Die Methode wird von Behörden wie EMA, FDA und ICH aufgrund ihrer Reproduzierbarkeit und validierten Leistung breit anerkannt.
- Vielseitigkeit in Anwendungen
Radioaktive Markierung kann auf eine breite Palette von Molekülen angewendet werden, einschließlich kleiner Moleküle, Peptide, Nukleotide, Lipide und sogar anorganische Verbindungen. Die Markierungspositionen können präzise gewählt werden, basierend auf der metabolischen Stabilität oder dem analytischen Fokus der Studie.
Zusammenfassung
Während alternative Markierungsmethoden wie Fluoreszenz, stabile Isotope oder Immunoassays ihre Berechtigung haben, bleiben radioaktive Tracer in Anwendungen, die hohe Sensitivität, absolute Quantifizierung, strukturelle Treue und regulatorische Zuverlässigkeit erfordern, unverzichtbar. Ihre Rolle in der molekularen Forschung, der klinischen Entwicklung und der diagnostischen Bildgebung bleibt besonders dann entscheidend, wenn keine Abstriche bei der Präzision gemacht werden dürfen.
Was ist spezifische Aktivität?
Die spezifische Aktivität eines Isotops gibt die Menge an Radioaktivität pro molarer Masse des jeweiligen Moleküls an. Sie wird üblicherweise in GBq/mmol (oder Ci/mmol) angegeben.
Das theoretische Maximum von ³²P beträgt 337 TBq/mmol = 9130 Ci/mmol. Bei diesem Maximum sind alle Phosphoratome ³²P, und es sind keine nicht-radioaktiven ³¹P-Atome vorhanden. Das Video zeigt ein ³²P-markiertes Nukleotid mit einer spezifischen Aktivität von 6000 Ci/mmol, bei dem sechs von maximal neun Atomen „rotieren“. Die sechs repräsentieren die ³²P-Isotope („heiß“), die anderen drei sind nicht-radioaktiv („kalt“). Nach einer Halbwertszeit (~14 Tage) sind die Hälfte der sechs Atome verschwunden, was dem Zerfall von drei ³²P-Atomen zu nicht-radioaktivem Schwefel entspricht, während drei „heiße“ ³²P-Atome verbleiben.
Die Lösung enthält nun drei „heiße“ und drei „kalte“ Phosphoratome. Die entstandenen Schwefelatome müssen ignoriert werden, da die zerfallenen Phosphoratome aus der Molaritätsberechnung herausfallen. Folglich sind nun nur noch 50 % der Phosphoratome „heiß“ und die spezifische Aktivität ist von 6000 Ci/mmol auf 4500 Ci/mmol gesunken, während die Radioaktivität innerhalb einer Halbwertszeit um 50 % abgenommen hat. Nur in carrier-free Lösungen würde der Rückgang der spezifischen Aktivität mit dem Rückgang der Radioaktivität übereinstimmen.
Wie konvertiert man Einheiten von Curie (Ci) zu Becquerel (Bq)?
Von
(µCi / mCi / Ci) | Zu
(kBq / MBq / GBq) | Von
(µCi / mCi / Ci) | Zu
(kBq / MBq / GBq) |
|---|
| 1 |
37 |
35 |
1290 |
| 2 |
74 |
40 |
1480 |
| 3 |
111 |
45 |
1660 |
| 4 |
148 |
50 |
1850 |
| 5 |
185 |
55 |
2030 |
| 6 |
222 |
60 |
2220 |
| 7 |
259 |
65 |
2400 |
| 8 |
296 |
70 |
2590 |
| 9 |
333 |
75 |
2770 |
| 10 |
370 |
80 |
2960 |
| 15 |
555 |
85 |
3140 |
| 20 |
740 |
90 |
3330 |
| 25 |
925 |
95 |
3510 |
| 30 |
1110 |
100 |
3700 |
|
CURIES TO BEQUERELS CONVERSION TABLE
|
|
to convert
|
to convert
|
|
From
|
To
|
From
|
To
|
|
µCi
mCi
Ci
|
kBq
MBq
GBq
|
µCi
mCi
Ci
|
kBq
MBq
GBq
|
|
1
2
3
4
5
6
7
8
9
10
15
20
25
30
|
37
74
111
148
185
222
259
296
333
370
555
740
925
1110
|
35
40
45
50
55
60
65
70
75
80
85
90
95
100
|
1290
1480
1660
1850
2030
2220
2400
2590
2770
2960
3140
3330
3510
3700
|
Berechnung der chemischen Konzentration aus spezifischer Aktivität und radioaktiver Konzentration
[alpha-32P]-ATP:
Spezifische Aktivität:
5000 Ci/mmol = 5 Ci/µmol = 5 mCi/nmol
Radioaktive Konzentration:
10 mCi/ml = 5 mCi/500 µl
Durch Gleichsetzen von 5 mCi/nmol und 5 mCi/500 µl ergibt sich die chemische Konzentration:
1 nmol/500 µl = 2 nmol/ml = 2 µmol/L = 2 µM
Welche Nomenklatur verwendet HARTMANN ANALYTIC?
Unsere Benennungskonvention
Die Website und der Katalog von HARTMANN ANALYTIC verwenden das Nomenklatursystem, das als „square bracket preceding“-System bekannt ist und derzeit von der American Chemical Society sowie vielen wissenschaftlichen Zeitschriften genutzt wird. Produkte werden alphabetisch nach dem vollständigen chemischen Namen aufgelistet, gefolgt von einer Klammer. Die Informationen in der Klammer beschreiben die Position und Art der radioaktiven Markierung. Komma, Leerzeichen und Bindestrich geben an, dass alles zwischen ihnen vor den chemischen Namen gesetzt werden sollte, um das „square bracket preceding“-Format zu erhalten.
Beispiel: Adenine, [8-¹⁴C] im Katalog sollte als [8-¹⁴C] Adenine gelesen werden.
Spezifisch markierte Verbindungen
Chemikalien werden als spezifisch markiert bezeichnet, wenn alle markierten Positionen identifiziert sind und die Radioaktivität an diesen Positionen mehr als 95 % der insgesamt in die Verbindung eingebrachten Radioaktivität ausmacht. Wenn mehr als eine Position markiert ist, bedeutet dies nicht, dass eine gleichmäßige Verteilung vorliegt.
Gleichmäßig markierte (U) Verbindungen
Diese Bezeichnung gilt für Verbindungen, die an allen Positionen in einem gleichmäßigen oder nahezu gleichmäßigen Muster markiert sind. Dazu gehören Verbindungen, die durch Biosynthese aus Kohlendioxid [¹⁴C] oder aus einem gleichmäßig markierten Zwischenprodukt hergestellt wurden.
Nominell markierte (N) Verbindungen
Diese Bezeichnung wird verwendet, wenn die Herstellungsweise verlangt, dass ein Teil (in der Regel ein signifikanter Anteil) der Markierung an einer bestimmten Position oder mehreren bestimmten Positionen liegt, aber keine weiteren Informationen über das Ausmaß der Markierung an anderen Positionen vorliegen.
Allgemein markierte Verbindungen
Verbindungen (in der Regel mit Tritium markiert), die keine spezifisch zugewiesene Markierungsposition haben und bei denen die Radioaktivität zufällig (d. h. nicht gleichmäßig und nicht genau bestimmt) an verschiedenen Positionen verteilt ist. Unter den Bedingungen, die zu zufälliger Markierung führen, enthalten viele potenzielle Markierungsstellen keine Radioaktivität.
| Isotope | Halbwertszeit | Type of radiation | Emissionsenergie | Max. Reichweite in der Luft | Empfohlene Abschirmung | Freigrenze |
|---|
| Ac225+ |
9.92 d |
α |
5.935 MeV |
5 cm |
Plastic |
10 kBq |
| C13 |
stable |
— |
— |
— |
Plastic |
10 MBq |
| C14 |
5730 y |
β |
0.156 MeV |
22 cm |
Plastic |
10 MBq |
| Ca45 |
163 d |
β |
0.257 MeV |
30 cm |
Acrylic glass |
1 MBq |
| Cl36 |
301 000 y |
β |
0.709 MeV |
1 m |
Lead (mm) or concrete (cm) |
— |
| Cr51 |
27.7 d |
β, γ |
320 keV |
several meters |
— |
— |
| Cs134 |
754 d |
β, γ |
0.66 MeV (β), several γ-lines |
2 m (β), several meters (γ) |
Acrylic glass & lead |
10 kBq |
| D2 |
stable |
— |
— |
— |
— |
— |
| Fe55 |
2.73 y |
EC |
5.9 keV |
1 cm |
Plastic or aluminum foil |
1 MBq |
| Fe59 |
44.5 d |
β, γ |
1.56 MeV (β, max.); 1.7 MeV & 1.29 MeV (γ) |
3 m (β), several meters (γ) |
Acrylic glass & lead |
1 MBq |
| H3 |
12.3 y |
β |
18.6 keV |
6 mm |
Plastic |
1 GBq |
| I125 |
59.4 d |
γ |
35 keV |
30 cm |
Lead |
1 MBq |
| I131 |
8.02 d |
β, γ |
0.61 MeV (β); 0.364 MeV (γ) |
2 m |
Lead |
1 MBq |
| Lu177 |
6.65 d |
β, γ |
0.498 MeV (β); 113 & 208 keV (γ) |
2 m (β), several meters (γ) |
Acrylic glass & lead |
10 MBq |
| N15 |
stable |
— |
— |
— |
— |
— |
| P32 |
14.3 d |
β |
1.71 MeV |
6 m |
Acrylic glass & lead |
100 kBq |
| P33 |
25.3 d |
β |
0.249 MeV |
25 cm |
Acrylic glass |
100 MBq |
| S35 |
87.5 d |
β |
167 keV |
24 cm |
Plastic |
100 MBq |
| Se75 |
120 d |
EC, γ |
121, 136, 265 keV |
several meters |
Lead |
1 MBq |
| Y90 |
64 h |
β |
2.28 MeV |
5 m |
Acrylic glass & lead |
100 kBq |
| Yb169 |
32 d |
β, γ |
0.3 MeV (β); 63, 109, 307 keV (γ) |
several meters |
Acrylic glass & lead |
10 MBq |
| Zn65 |
244 d |
EC, γ |
1.115 MeV |
several meters |
Lead |
1 MBq |
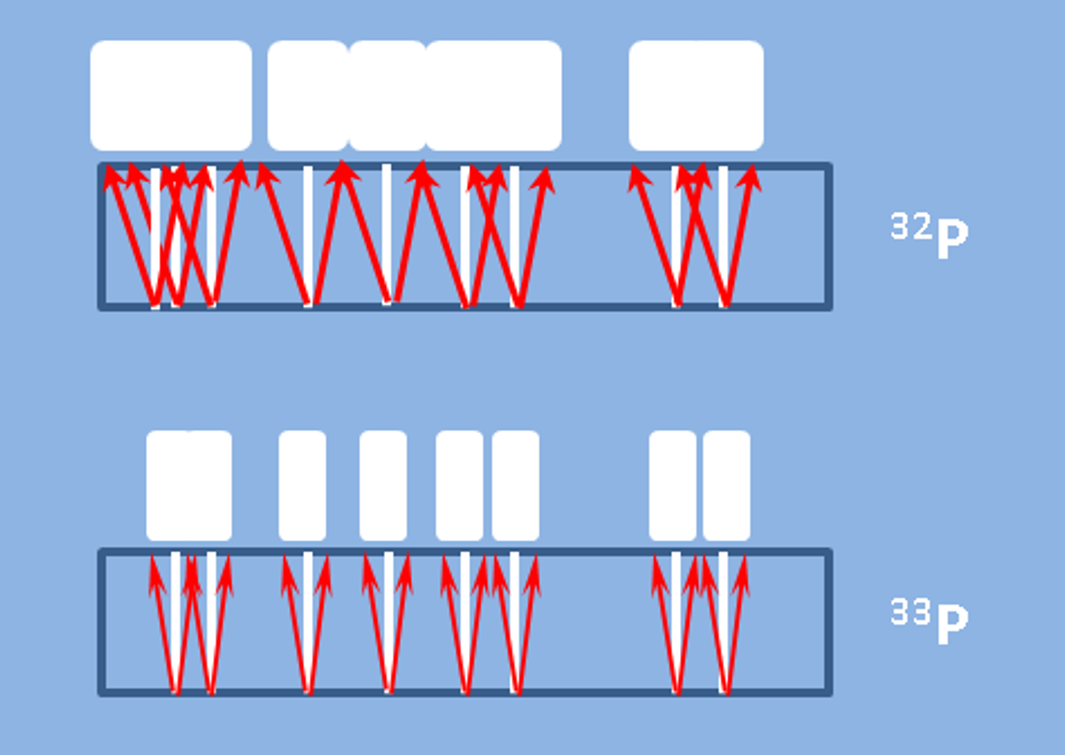
Vorteile von P-33 im Vergleich zu P-32
Haben Sie schon einmal darüber nachgedacht, Phosphor-33 (P-33) als sichere und praktischere Alternative zu Phosphor-32 (P-32) in Ihren Assays einzusetzen? Während P-32 aufgrund seiner hochenergetischen Betastrahlung und des starken Signals weit verbreitet ist, bietet P-33 mehrere wichtige Vorteile, die es für viele aktuelle Anwendungen geeigneter machen:
- Geringeres Strahlenrisiko
P-33 emittiert Beta-Partikel mit niedrigerer Energie (maximale Energie ~0,25 MeV) im Vergleich zu P-32 (~1,71 MeV), wodurch das Risiko einer Strahlenexposition für das Personal deutlich reduziert wird. Dies macht P-33 besonders im Routinebetrieb oder bei Langzeitexperimenten wesentlich sicherer im Umgang
- Bessere Auflösung in der Autoradiographie
Die niedrigeren Energieemissionen von P-33 führen zu schärferen und höher aufgelösten Autoradiographien. Dies ist besonders vorteilhaft bei Nukleinsäuren- oder Proteingelen, bei denen eine präzise Bandenauflösung entscheidend ist.�
- Längere Halbwertszeit
P-33 hat mit ~25,3 Tagen eine längere Halbwertszeit als P-32 (~14,3 Tage), was eine längere Nutzbarkeit ermöglicht und Abfall aufgrund kurzer Lagerfähigkeit reduziert. Dies kann zu Kosteneinsparungen und besserer Experimentplanung führen.
- Reduzierte Probenbeschädigung
Die niedrigere Energie von P-33 minimiert radiolytische Schäden an markierten Nukleinsäuren oder Proteinen. Dies ist besonders relevant in Experimenten, bei denen die Probenintegrität wichtig ist, wie Sequenzierungen, Bindungsassays oder Struktur-Funktions-Studien.
- Strahlenschutz und regulatorische Vorteile
Durch das geringere Strahlenrisiko kann die Nutzung von P-33 die Einhaltung von Strahlenschutzvorschriften erleichtern und den Bedarf an spezieller Abschirmung und Überwachungsverfahren im Labor reduzieren. Die Freigrenze von P-33 beträgt laut Strahlenschutzverordnung 100 MBq, während sie für P-32 lediglich 0,1 MBq beträgt.
Obwohl P-33 pro Aktivitätseinheit etwas teurer sein kann, überwiegen seine Vorteile in Bezug auf Sicherheit, Datenqualität und Handhabungskomfort häufig die zusätzlichen Kosten – insbesondere in Anwendungen, bei denen Auflösung und Reproduzierbarkeit entscheidend sind.